首届金研奖:章真、朱骥教授Cinclare研究
2021-12-13 18:43·
第二届金研奖-2021年度中国临床肿瘤十大原创研究评选已于12月12日正式启动!
速度扫描下方二维码报名自荐哦↓↓↓

2020年以来,疫情对我们正常工作和生活的影响一直在持续,但中国肿瘤医生在国际上的学术/科研影响力却“欣欣向荣”——在ASCO、ESMO、WCLC、ASH等国际会议上不断传出中国好声音,在The Lancet Oncology、JCO等国际高影响力的专业期刊上中国医者亦笔耕不辍,成果频出。
为了表彰他们的优秀成果和突出贡献,十大原创研究评选于2020年正式更名为金研奖,在第二届金研奖即将开启之际,良医汇将同大家一起回顾首届金研奖获奖者,致敬中国原创研究者!
2020年以来,疫情对我们正常工作和生活的影响一直在持续,但中国肿瘤医生在国际上的学术/科研影响力却“欣欣向荣”——在ASCO、ESMO、WCLC、ASH等国际会议上不断传出中国好声音,在The Lancet Oncology、JCO等国际高影响力的专业期刊上中国医者亦笔耕不辍,成果频出。
为了表彰他们的优秀成果和突出贡献,十大原创研究评选于2020年正式更名为金研奖,在第二届金研奖即将开启之际,良医汇将同大家一起回顾首届金研奖获奖者,致敬中国原创研究者!

研究简介
局部晚期直肠癌的标准治疗模式为卡培他滨为基础的新辅助治疗联合全直肠系膜切除,在此基础上,复旦大学附属肿瘤医院的章真团队、中国科学院大学附属肿瘤医院朱骥教授团队携手全国17个中心历时8年开展了CinClare研究,在UGT1A1基因的引导下,探索了新辅助放化疗同期联合伊立替康的疗效,以期进一步提高局部晚期直肠癌患者的肿瘤退缩率,并使更多的患者获益。CinClare研究的结果显示,同期联用伊立替康可将病理完全缓解(pCR)率较标准治疗组提升近1倍,为当前的治疗模式提供了新方案。2020年10月30日,肿瘤学顶级期刊《临床肿瘤学杂志》( Journal of Clinical Oncology ; JCO ;影响因子32.985)在线发表了该研究的结果,充分体现了国际同行对该研究结果的高度认可。


章真
主任医师,教授,博士生导师
复旦大学肿瘤医院放疗中心主任
中国医师协会放疗分会副主委
中华医学会放射治疗专业委员会常委
CSCO放射治疗专委会副主委
上海医学会放疗专委会候任主任委员
上海市抗癌协会放疗专委会主委
上海市领军人才
NCI直肠癌工作组成员

朱骥
主任医师,博士生导师
中国科学院大学附属肿瘤医院院长助理,科研部主任
腹部放疗科主任医师,博士生导师
肿瘤学博士,流行病与卫生统计学硕士
CSCO生物统计专委会副主任委员
CSCO青年专家委员会常委
中国抗癌协会大肠癌专业委员会委员、放疗学组副组长
中国抗癌协会支持治疗专业委员会常委、放疗学组副组长
中国外科医师协会MDT专委会青委会副主任委员
中华医学会临床流行病分会循证医学学组委员
中国中西医结合学会普外专委会直肠癌防治专家委员会常委
浙江省抗癌协会放射治疗专委会候任主任委员
上海市抗癌协会放射治疗专委会秘书长/青委会副主任委员
上海市医学会放射治疗专委会青委会副主任委员
上海市医学会临床流行病分会委员
发表学术论文100余篇,其中SCI论文近80篇,第一或通讯作者发表SCI论文25篇,包括J Clin Oncol,Ann Oncol等,研究成果已改变2021版CSCO直肠癌治疗指南(CinClare研究)。发起成立“医统江湖”、“腹部放疗青年沙龙(CARTOnG)”协作平台。
研究背景及目的
作为新辅助放化疗的联合用药,伊立替康的疗效早已有了相关报道,但由于担心患者的耐受性差而限制了伊立替康的广泛应用。有研究报道,尿苷二磷酸葡萄糖醛酸转移酶1A1(UGT1A1)基因型是影响伊立替康剂量的关键因素。因此,CinClare研究旨在探究新辅助放化疗同期联用伊立替康的疗效,这也是首个在UGT1A1基因型指导下,将伊立替康联用于局部晚期直肠癌新辅助放化疗的Ⅲ期临床试验。
研究方法
这是一项在中国17个中心开展的随机、开放标签、多中心的Ⅲ期临床试验。
入选标准为:患者年龄在18~75岁之间,经组织病理学确认为直肠腺癌,肿瘤距离肛门≤10cm,盆腔磁共振(MRI)显示肿瘤的临床分期为cT3~4和/或N+,常规的胸部和腹部CT扫描未见远处转移。其他的纳入标准包括Karnofsky评分≥70;所有患者均接受UGT1A1基因型的检测,并确定基因型为*1*1或*1*28型;骨髓造血功能及肝肾功能正常。主要的排除标准为:除外皮肤基底细胞癌或原位宫颈癌的恶性肿瘤史;既往接受过化学治疗或盆腔放疗;怀孕或哺乳期女性;患有二氢嘧啶脱氢酶缺乏症以及在过去的12个月内出现过严重疾病,如不稳定性心绞痛或心肌梗塞。
研究方案:对照组(CapRT)接受盆腔调强放疗(50 Gy/25次),同期口服卡培他滨(825 mg/m2/d,bid,d1~5),放化疗结束后2周采用卡培他滨加奥沙利铂(XELOX)化疗1程(奥沙利铂130 mg/m2,d1,卡培他滨1000 mg/m2,bid,d1~14)。试验组(CapIriRT)接受50 Gy/25次盆腔放疗,同期口服卡培他滨(625 mg/m2/d,bid,d1~5),每周接受1次伊立替康化疗,并在放化疗完成后2周进行卡培他滨加伊立替康(XELIRI)方案化疗(伊立替康200 mg/m2,d1,卡培他滨1000 mg/m2,bid,d1~14)。值得注意的是,研究者根据患者的UGT1A1的基因型对患者的伊立替康周化疗剂量进行了调整,对于UGT1A1* 1 * 1的患者,伊立替康的剂量为80 mg/m2,而UGT1A1 * 1 * 28型患者的剂量为65 mg/m2。放化疗完成后8周进行手术,术后均采用5个周期的XELOX方案辅助化疗。
统计分析:研究预计将pCR率从CapRT组的12%提升至CapIriRT组的25%,主要研究终点为意向治疗(ITT)人群的pCR率。次要终点包括毒性、生活质量、肿瘤消退等级、括约肌保存、手术并发症、局部控制、无病生存期(DFS)和总生存期(OS)。
研究计划招募360例合格患者,双侧检验水平%u3B1=0.05,检验效能为85%。由于部分患者接受全新辅助治疗后拒绝接受手术,因此,研究者计划进行两次敏感性分析以确认结果的稳健型,包括手术人群的pCR率和ITT人群的完全缓解(CR)[病理完全缓解(pCR)+临床完全缓解(cCR)]率。对肿瘤退缩良好且拒绝根治手术的患者采取“观察等待”策略(watch-and-wait policy)。具体的策略包括:6个周期的巩固化疗,每1~2个月进行直肠指检,每3个月进行一次胸部和腹部CT以及盆腔MRI检查。将cCR定义为放化疗后至少12个月,直肠指检未触及肿瘤,盆腔MRI或肠镜检查无肿瘤残留且肿瘤持续消失。
研究结果
2015年11月至2017年12月,中国共17个中心招募了360例患者,4例因撤回知情同意被排除,共356例患者组成了改良的ITT(mITT)人群(图1)。表1显示了两组患者的基线信息和临床特征。
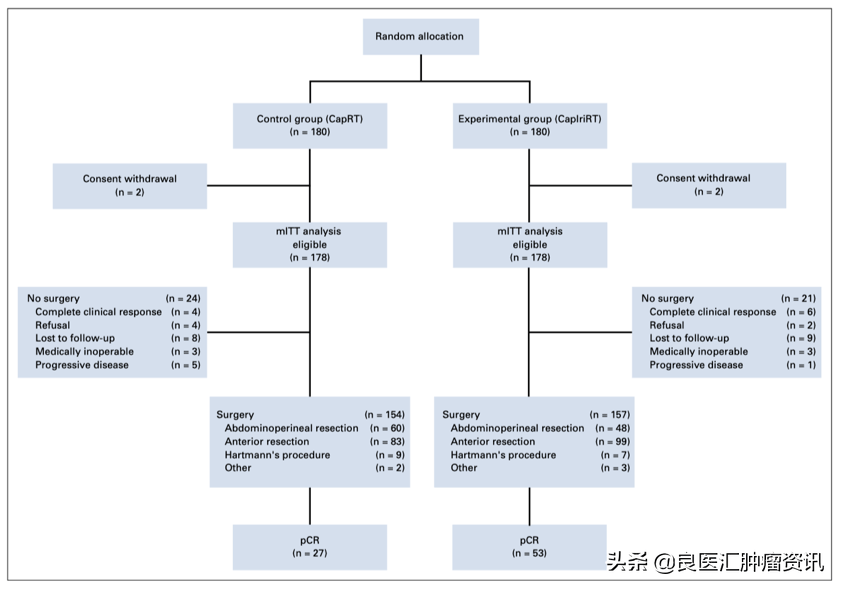
图1. CinClare研究的CONSORT图
表1. 入组患者基线特征

新辅助放化疗的依从性与毒性
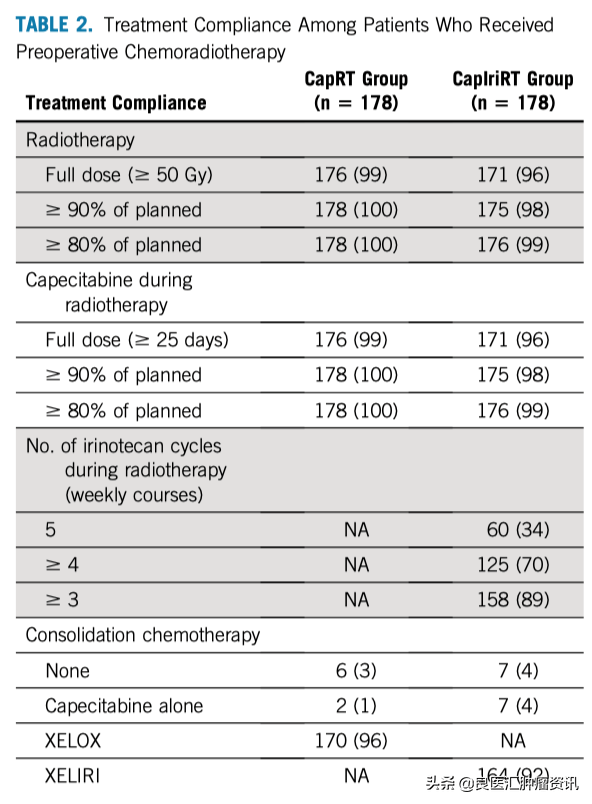
CapRT组所有(100%)患者都接受了≥90%的放疗和卡培他滨计划剂量治疗。在CapIriRT组中,有175例(98%)患者接受了≥90%的放疗和卡培他滨计划剂量治疗,125例(70%)患者接受了至少4个周期的伊立替康周化疗(表2)。
表2. 患者接受新辅助治疗的依从性
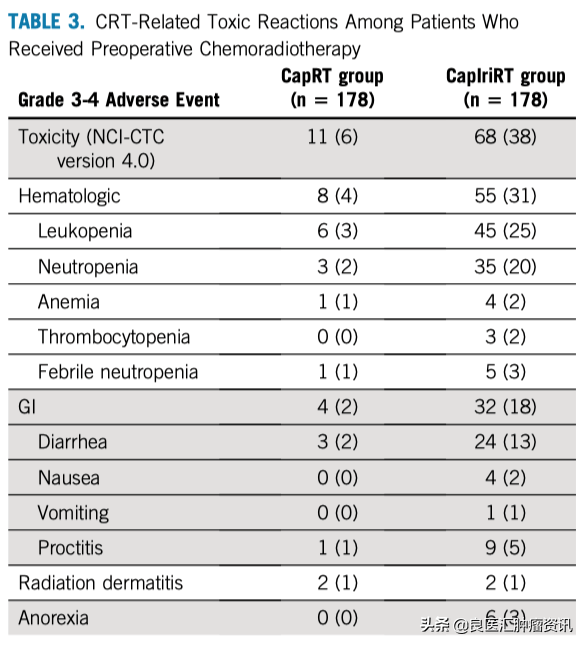
CapRT组和CapIriRT组3~4级毒性反应的发生率分别为6%和38%(P< 0.001)。两组在放化疗期间最常见的3~4级毒性分别是白细胞减少症(3% vs 25%),中性粒细胞减少症(2% vs 20%)和腹泻(2% vs 13%)(表3)。
表3. 新辅助放化疗的毒性反应发生率
手术及病理结局
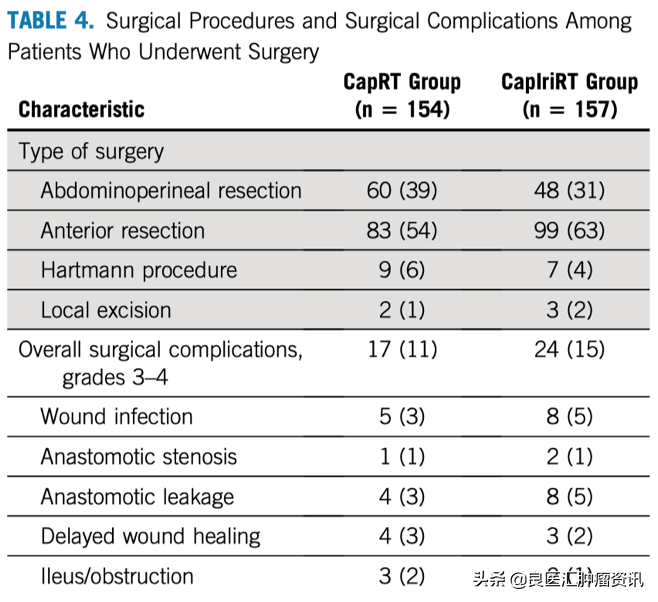
CapRT组和CapIriRT组各有154例(87%)和157例(88%)患者接受了手术。CapRT组放化疗结束至手术的中位间期为61天(范围 45~104天),CapIriRT组为62天(范围 4~156天)。CapRT组和CapIriRT组患者接受腹会阴联合切除术(APR)的比例分别为39%和31%(P = 0.120),两组术后出现3级以上并发症的患者比例相似(11% vs 15%;P= 0.268),手术后60天内均无患者死亡。见表4。
表4. 手术患者的手术类型及术后并发症情况
CapRT组中有148例患者(96%)接受了根治手术,CapIriRT组有153例(97%),两组分别有7例(5%)和3例(2%)患者的环切缘≤1 mm。CapRT组和CapIriRT组分别有27例(18%)和53例(34%)患者达到了pCR(HR= 1.93;P< 0.001)。两组的淋巴结阴性率分别为73%和74%。在mITT人群中,CapRT组的pCR率为15%,CapIriRT组为30%(HR= 1.96;P <0.001)(表5)。在CapRT组和CapIriRT组中分别有4例和6例患者在达到cCR后选择了“观察等待”策略,各有20例和5例患者由于各种原因未进行手术,包括拒绝手术、失访、无法手术或疾病进展。两次敏感性分析均显示主要终点的数据是一致的。
表5. 手术患者的病理结局
研究结论
CinClare研究是首个探究在局部晚期直肠癌新辅助放化疗中联合卡培他滨和伊立替康剂量的Ⅲ期临床试验。该研究的pCR率从CapRT组的15%增加到CapIriRT组的30%,达到了主要研究终点,但值得注意的是3~4级毒性反应的发生率也明显增加(38%),尤其是白细胞减少症(25%)、中性粒细胞减少症(20%)和腹泻(13%)。总体而言,联合伊立替康的新辅助放化疗方案在中国人群中是安全可行的。
讨论
伊立替康在局部晚期直肠癌新辅助治疗中的应用
伊立替康是一种拓扑异构酶Ⅰ抑制剂。临床前研究表明,伊立替康还可以与放疗联合产生良好的协同作用。但是,既往的Ⅰ/Ⅱ期试验中,新辅助治疗同期联用伊立替康并未增加肿瘤的完全缓解率,究其原因,可能是由于伊立替康的剂量不足所致。有研究显示,接受总伊立替康剂量为240 mg/m2的患者的pCR率为16%~35%,而总剂量为200 mg/m2的患者的pCR率为0。因此,研究者认为伊立替康仅在足够剂量时才可能是理想的放射增敏剂。然而,由于伊立替康毒性限制了其在临床试验中的验证。
UGT1A1基因型引导下伊立替康的剂量探索
有研究报道了UGT1A1基因型影响了伊立替康的最大耐受剂量(MTD),然而缺乏大样本研究的验证。在白人中,UGT1A1* 1 * 1和* 1 * 28基因型的比例分别为46%和39%,而亚洲人群中这一比例分别为80%和16%。白人与亚洲人群中伊立替康的MTD也有显著差别。因此,复旦大学附属肿瘤医院进行了一系列研究,探究UGT1A1基因型引导下新辅助放化疗同期联用伊立替康的剂量。Ⅰ期的剂量爬坡研究确定了* 1 * 1基因型患者的伊立替康MTD高达每周80 mg/m2,* 1 * 28基因型患者的MTD高达每周65 mg/m2。这一剂量明显高于以往研究,也可能是提高pCR率的主要原因。CinClare研究是在此剂量爬坡的基础上进行的Ⅲ期随机对照研究,进一步证明了在UGT1A1基因型引导下新辅助治疗同期联合伊立替康可提升患者的pCR率。
参考文献
回顾
【首届金研奖回顾01】ZGDH3研究:多纳非尼对比索拉非尼一线治疗晚期肝细胞癌,一项开放标签的多中心随机Ⅱ/Ⅲ期研究
责任编辑:Yoly
排版编辑:Warren
版权声明
版权归肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。
免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。
举报邮箱:3220065589@qq.com,如涉及版权问题,请联系。








网友评论